Opieka farmaceutyczna
Nitrozoaminy w lekach i życiu codziennym
Skrót informacji
Powszechne występowanie N-nitrozoamin (NDMA) w środowisku człowieka i zwierząt wskazuje na wagę problemu jako potencjalnego, trudnego do oszacowania zagrożenia zdrowia człowieka-konsumenta.
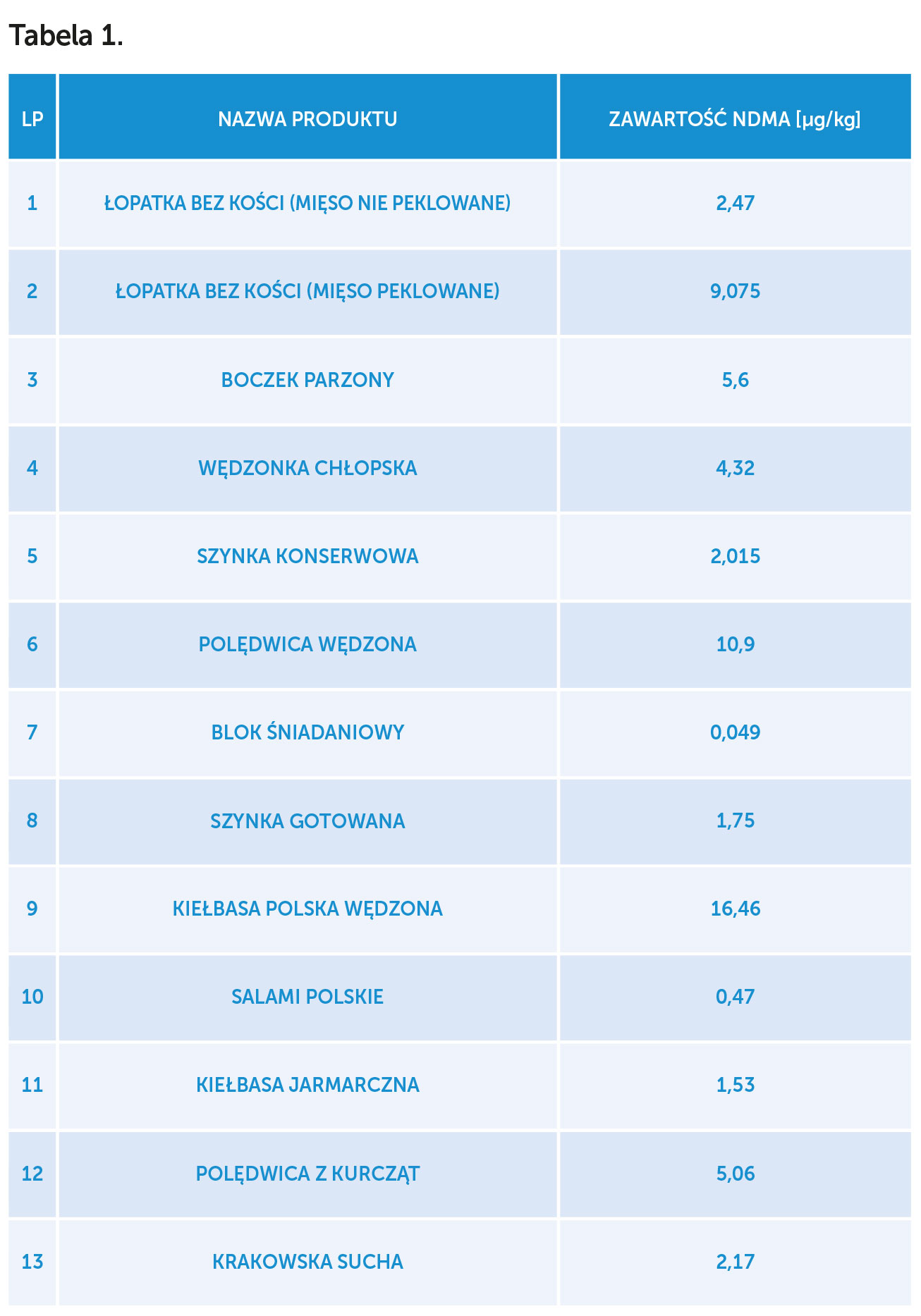
Nitrozoaminy (NDMA) powstają głównie w wyniku reakcji między aminami drugo- i trzeciorzędowymi a azotynami. Reakcje te mogą zachodzić podczas ogrzewania żywności oraz w organizmie człowieka, zwłaszcza w żołądku w obecności kwaśnego soku żołądkowego. Prawie zawsze wykrywa się nitrozoaminy w żywności zawierającej azotany. Żywność konserwowana, zwłaszcza kiedy jest ogrzewana, może zawierać nawet do 100000 ng/kg N-nitrozodimetylaminy (NDMA). Najczęściej NDMA spotyka się na poziomie ok. 10000 ng/kg, choć w niektórych produktach zawartość NDMA jest znacznie wyższa.
W badaniach różnych gatunków mięs Ciemniak[1] stwierdził następujące poziomy NDMA przedstawione w tabeli 1.
Dobowe narażenie na NDMA w diecie kształtuje się różnie w poszczególnych krajach. W Finlandii oszacowano je w 2008 r. na 80 ng/dobę, a w Japonii na 1800 ng/dobę. Przeciętne spożycie NDMA wynosi od 100 do 1100 ng/dobę.
W Kanadzie po przebadaniu 121 prób mięsa NDMA wykryto we wszystkich próbach, w ilości od 100 do 17200 ng/kg.
Inne dane wykazują, że spożycie NDMA wraz z pokarmem wynosi 30 ng/kg masy ciała w ciągu doby, a wraz z wodą pitną 0,24 pg/L w ciągu doby. Palacz dodatkowo narażony jest na dawkę 5600 ng NDMA w ciągu doby.[7]
Nitrozoaminy posiadają następujący ogólny wzór strukturalny:

Najbardziej znanym związkiem z tej grupy jest wspomniana N-nitrozodimetyloamina (NDMA). Trzeba jednak także pamiętać o innych nitrozoaminach, które są uwzględnione w tymczasowych limitach dobowego przyjęcia nitrozoamin z lekami, takich jak, N-nitrozodietyloamina (NDEA), kwas N-nitrozo N-metyloamino masłowy (NMBA), N-nitrozodiizopropyloamina (DIPNA) i N-nitrozoetyloizopropyloamina EIPNA).
NDMA i NDEA na podstawie badań na zwierzętach są klasyfikowane przez IARC (International Agency for Research on Cancer) jako prawdopodobne kancerogeny dla człowieka. Jedynie dla tych dwóch nitrozoamin dostępne są pełniejsze dane toksykologiczne. Przyjęte dobowe limity pobrania z lekami (poniżej) dla pozostałych pochodnych zostały oparte na ich podobieństwie strukturalnym do NDMA i NDEA.[8, 11]
W swoim działaniu kancerogennym N-nitrozoaminy wykazują charakterystyczną organotropię, która przejawia się tym, że zależnie od swej budowy chemicznej poszczególne związki selektywnie indukują nowotwory w określonych narządach i tkankach zwierząt doświadczalnych. NDMA wywołuje zwykle nowotwory wątroby, a NDBA raka pęcherza moczowego.[6]
Powszechne występowanie N-nitrozoamin w środowisku człowieka i zwierząt wskazuje na wagę problemu jako potencjalnego, trudnego do oszacowania zagrożenia zdrowia człowieka-konsumenta. Ustalenie podstawowego narażenia na nitrozoaminy pochodzące ze źródeł endogennych i egzogennych jest uzależnione od wielu czynników, takich jak dieta, styl życia czy miejsce zamieszkania.
W krajach UE nie ustalono maksymalnych dopuszczalnych limitów dla N-nitrozoamin w produktach spożywczych. W USA obowiązuje limit 10000 ng/kg (całkowita zawartość lotnych N-nitrozoamin) dla wędlin. W Chinach wprowadzono limity dla ryb i produktów pokrewnych (4000 i 7000 ng/kg). Najostrzejsze regulacje obowiązują na obszarze Unii Celnej Republiki Białorusi, Republiki Kazachstanu i Federacji Rosyjskiej (2000 do 4000 ng/kg).[6]
W czerwcu 2018 r. wykryto obecność nitrozoamin w lekach hipotensyjnych z grupy sartanów. Do tego czasu nitrozoaminy nie były wykrywane w sartanach. Prace nad ustaleniem potencjalnego źródła zanieczyszczeń nitrozoaminami doprowadziły do wniosku, że związki te potencjalnie mogą być obecne w innych lekach.
W krótkim czasie wykryto ślady NDMA w chlorowodorku pioglitazonu pochodzącym od jednego z producentów tej substancji czynnej, a ostatnio w ranitydynie oraz metforminie. O ile w przypadku sartanów powstawanie nitrozoamin wiązane jest z obecnością pierścienia tetrazolowego w strukturze cząsteczki, to źródło tego zanieczyszczenia w innych lekach nie zostało jednoznacznie ustalone. Przypuszcza się, że mogą one powstawać w obecności określonych rozpuszczalników, różnych odczynników i surowców wyjściowych. Przyczyną ich powstawania może być też stosowanie w procesie produkcyjnym azotynów w obecności amin II- i III-rzędowych. Wymienia się w tym kontekście również możliwość zanieczyszczeń linii produkcyjnych oraz opakowań.[5]
Informacje o występowaniu NDMA w ranitydynie zostały potwierdzone w badaniach, w których stwierdzano powstawanie tego związku z ranitydyny w kwaśnym pH w obecności azotynów. Analiza produktów obecnych na rynku amerykańskim doprowadziła do wykrycia obecności NDMA w zakresie od 10 ng/tabl. zawierającą 150 mg ranitydyny do 860 ng/tabl. zawierającą 300 mg ranitydyny, zależnie od producenta.[4]
W konsekwencji wstrzymano obrót ranitydyną w lekach skali światowej, łącznie z USA i Europą. Europejska Agencja Leków (EMA) 12.09.2019 r. rozpoczęła postępowanie wyjaśniające mające na celu ustalenie źródeł zanieczyszczenia ranitydyny oraz ocenę ryzyka związanego ze stosowaniem ranitydyny.[3, 9] Również inne agencje rejestracyjne, takie jak FDA, zwróciły się o dobrowolne wycofanie produktów tylko wtedy, gdy wyniki testu wskazują, że poziomy NDMA są powyżej przyjętych poziomów przejściowych.[11] Wiele firm zainicjowało dobrowolne wycofanie z obrotu swoich produktów z ranitydyną.
W związku z wykryciem nitrozoamin w grupie sartanów na podstawie badań rakotwórczości na zwierzętach EMA opracowała tymczasowe limity (interim limits, IL) dobowego spożycia poszczególnych nitrozoamin, które przejściowo stosowane mają być do wszystkich kategorii leków syntetycznych. I tak wartość ta dla NDMA i NMBA została ustalona na poziomie 96,0 ng/dobę, a dla NDEA, NDBA DIPNA i EIPNA na 26,5 ng/dobę.[10]
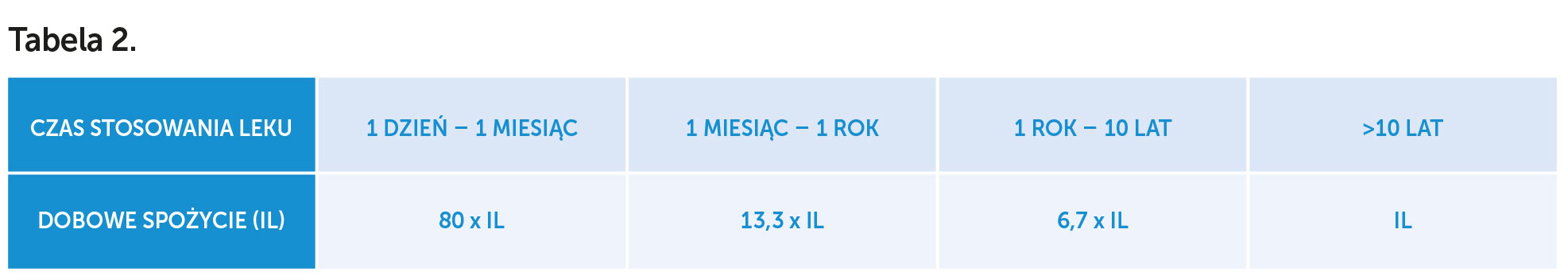
W oparciu o ustalenia wytyczne ICH M7 (R1) teoretycznie możliwe jest podwyższenie wskazanych limitów dobowych, zależnie od czasu stosowania leku[8] (patrz: tabela 2).
Niemniej jednak zawsze musi być brane pod uwagę potencjalnie najdłuższe stosowanie leku, zgodne ze wskazaniami ujętymi w Charakterystyce Produktu Leczniczego. Dlatego, np. w przypadku ranitydyny wydawanej na receptę, która stosowana może być w zespole Zollingera-Ellisona >10 lat, należy brać pod uwagę wartość IL dla NDMA, tj. 96,0 ng/dobę.
Wykrycie nitrozoamin najpierw w sartanach, a później w kolejnych grupach leków, spowodowało określone działania ze strony władz rejestracyjnych na całym świecie. W Unii Europejskiej, w następstwie przeglądu sartanów zagrożonych zawartością nitrozoamin, na podstawie art. 31 Dyrektywy 2001/83/WE producentom zalecono dokonanie oceny i wprowadzenie zmian w procesach produkcyjnych w celu zminimalizowania zanieczyszczeń nitrozoaminami. W Farmakopei Europejskiej dokonywane są korekty monografii sartanów obejmujące testowanie substancji czynnych pod kątem obecności nitrozoamin. Ponadto ogólna monografia dotycząca substancji czynnych jest w trakcie aktualizacji i obejmie również odpowiednie testy.[11]
Chociaż nitrozoaminy nie powinny się tworzyć podczas produkcji znacznej większości leków – jako ogólny środek ostrożności – EMA zaleciła podmiotom odpowiedzialnym dokonanie oceny zawartości nitrozoamin we wszystkich produktach leczniczych zawierających syntetyczne substancje czynne. W wyniku hipotetycznej możliwości zanieczyszczenia krzyżowego lub niezamierzonego wprowadzenia amin i azotynów zalecono producentom przeprowadzenie tego przeglądu w ciągu 6 miesięcy od opublikowania zaleceń (we wrześniu 2019 r.) oraz jak najszybsze przeprowadzenie badań, najpóźniej do 26.09.2022 r.[2]
--- R E K L A M A ---
Odleżyny – czynniki ryzyka i postępowanie
Naturalne wsparcie procesu trawienia