Opieka farmaceutyczna
Debutir Max – kierunkowe uwalnianie maślanu sodu jako nowy standard terapii jelitowej
Skrót informacji
Maślan, podstawowe źródło energii dla kolonocytów, odgrywa kluczową rolę w utrzymaniu integralności bariery jelitowej, regulacji odpowiedzi zapalnej oraz odżywianiu nabłonka jelitowego. Jego działanie zostało wielokrotnie potwierdzone w kontekście wsparcia leczenia zespołu jelita drażliwego (IBS), nieswoistych zapaleń jelit (IBD), choroby uchyłkowej oraz zaburzeń mikrobioty. W ostatnich latach w praktyce klinicznej coraz większą uwagę poświęca się końcowemu odcinkowi jelita cienkiego – jelitu krętemu, które poza jelitem grubym także odgrywa ważną rolę w zdrowiu przewodu pokarmowego.
[ARTYKUŁ SPONSOROWANY]
Wstęp
W opracowaniu uwzględniono najnowsze dane literaturowe podkreślające znaczenie maślanu w modulacji mikroflory jelitowej, immunomodulacji oraz prewencji chorób metabolicznych.
Funkcja maślanu w organizmie człowieka
Kwas masłowy działa troficznie i energetycznie na kolonocyty, wspiera regenerację śluzówki i utrzymanie szczelności bariery jelitowej. Jako ligand receptorów GPR41 i GPR43 wpływa na odpowiedzi immunologiczne i metabolizm (Kasubuchi et al., 2015). Indukuje ekspresję komórek Treg, wykazuje działanie przeciwzapalne i neuroprotekcyjne (Furusawa et al., 2013), a także jest intensywnie badany pod kątem udziału w terapii chorób metabolicznych, takich jak otyłość i cukrzyca typu 2 (Canfora et al., 2015). Działa również jako inhibitor deacetylazy histonowej (HDAC), regulując ekspresję genów związanych z apoptozą, proliferacją i regeneracją śluzówki (Davie, 2003).
Rola jelita krętego
Jelito kręte to szczególny odcinek przewodu pokarmowego, istotny dla wielu aspektów zdrowia i patofizjologii. Poniżej przedstawiono kluczowe powody, dla których jest ono ważne:
- to główne miejsce wchłaniania wielu substancji odżywczych i witamin (m.in. wit. B12, wit. D, sole żółciowe) (Fish et al. 2025);
- u około 45% pacjentów z chorobą Crohna zmiany chorobowe obejmują zarówno jelito grube, jak i dystalny odcinek jelita cienkiego (okolice zastawki krętniczo-kątniczej); kolejne 30% dotyczy wyłącznie jelita krętego. W zależności od populacji ponad 60% przypadków lokalizuje się właśnie w tym odcinku (Baumgart et al. 2012);
- w przypadku IBS i IBD bóle brzucha często mają swoje źródło w okolicy krętniczo-kątniczej – niezależnie od tego, czy zmiany dotyczą jelita grubego, czy cienkiego (Bielefeldt et al. 2009, Vergnolle 2022);
- jelito kręte to także najczęstsze miejsce rozwoju patologicznego przerostu bakteryjnego jelita cienkiego (SIBO) (Bushyhead et al. 2022); SIBO często współistnieje z IBS i IBD.
Coraz więcej doniesień wskazuje na potencjalną rolę maślanu w ograniczaniu patogennej kolonizacji oraz przywracaniu równowagi mikrobiologicznej w jelicie cienkim (Pimentel et al., 2020).
Znaczenie profilowanego uwalniania maślanu sodu
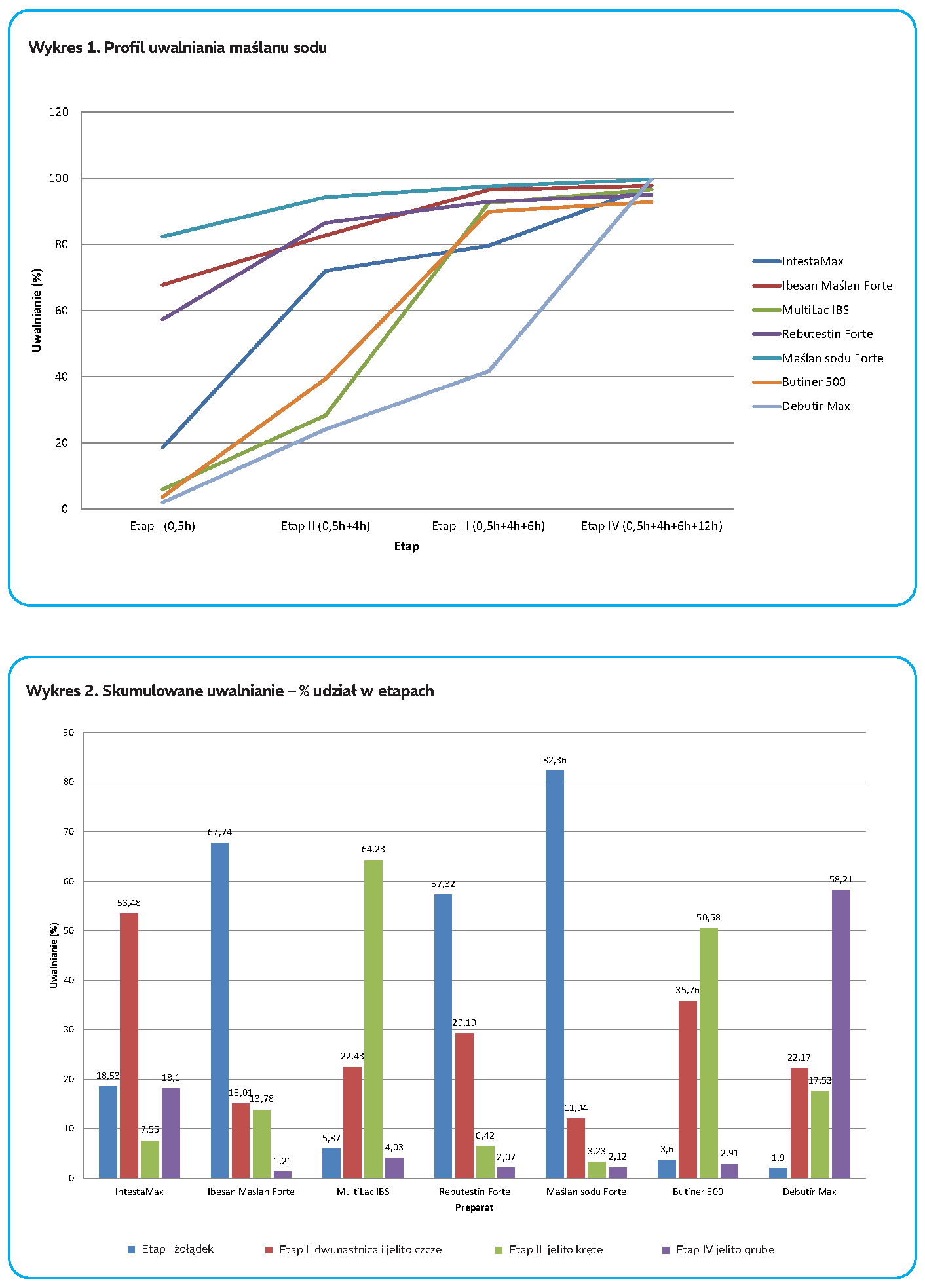
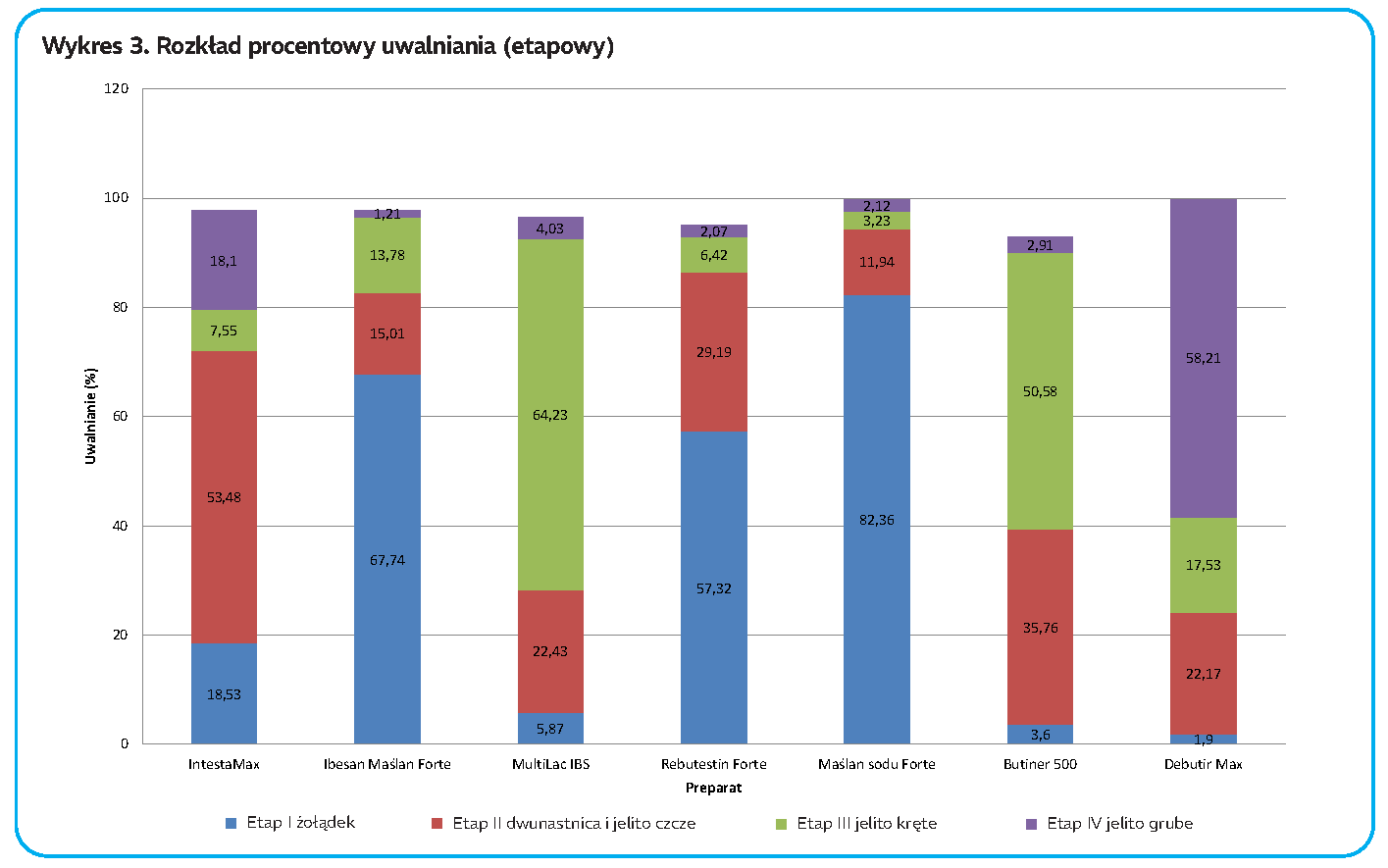
Jak wykazano we wcześniejszych publikacjach (Banasiewicz et al., 2019; Kiciak, 2023), skuteczność suplementacji maślanem zależy nie tyle od zastosowanej dawki, ile przede wszystkim od miejsca jego uwalniania w przewodzie pokarmowym.
Wykorzystanie kwasu masłowego w przewodzie pokarmowym jest absolutne, to znaczy, że w warunkach fizjologicznych trudno wyobrazić sobie jego przedawkowanie. W praktyce należy założyć, że dostępne (niechronione) jony maślanowe zostaną natychmiast i w całości wykorzystane jako źródło energii przez komórki nabłonka jelitowego tam, gdzie się pojawią – przez nabłonek jamy ustnej, przełyku, żołądka, jelita cienkiego i ostatecznie jelita grubego. Przy wyobrażalnych dawkach krystalicznego kwasu masłowego możliwych do przyjęcia dziennie, szansa na jego dotarcie do dalszych odcinków przewodu pokarmowego jest praktycznie zerowa. Szkopuł w tym, że zdecydowana większość chorób w obrębie przewodu pokarmowego lokalizuje się właśnie w dalszych jego częściach – jelicie krętym (dalsza część jelita cienkiego) i jelicie grubym, gdzie niechronione źródło kwasu masłowego (np. niechroniony maślan sodu) nie ma szansy dotrzeć po podaniu doustnym, przez pełne wykorzystanie „wcześniej”. Stąd kluczowe i potwierdzone klinicznie znaczenie kontrolowanego otoczkowaniem pasażu jonów maślanowych do dalszych odcinków przewodu pokarmowego dla ogólnej efektywności działania odżywczego preparatu. Jak wspomniano wyżej, większość chorób i stanów, w których stosowanie dietetyczne maślanu sodu może wspierać postępowanie farmakologiczne, dotyczy przede wszystkim jelita krętego i jelita grubego, a należą do nich między innymi: zespół jelita drażliwego, zaburzenia składu mikrobioty, choroba uchyłkowa, czy nieswoiste choroby zapalne jelit.
Celem niniejszego opracowania jest przedstawienie wyników najnowszej analizy porównawczej uwalniania maślanu sodu z wybranych preparatów obecnych na rynku polskim w tym w odniesieniu do nowej formulacji Debutir Max, która zawiera maksymalną dostępną ilość maślanu sodu o profilowanym uwalnianiu w jednej kapsułce – aż 500 mg. Co więcej, mikrogranulat maślanu sodu w Debutir Max został tak zoptymalizowany, aby uwalniać około 20% jonów maślanowych w jelicie krętym i około 60% w jelicie grubym, dokładnie tam, gdzie potrzebne jest wspomaganie zdrowotności nabłonka jelitowego.
Technologia mikrotoczkowania preparatu Debutir Max
Nowatorska technologia zastosowana w preparacie Debutir Max opiera się na wykorzystaniu mieszaniny mono- i diacylogliceroli jako nośnika kwasu masłowego (jonu maślanowego). W przeciwieństwie do rozwiązań opartych na triacyloglicerolach, zastosowanie wyłącznie mono- i diacylogliceroli (E471) umożliwia uzyskanie najwyższego stężenia maślanu sodu w granulacie – 75%, przy zachowaniu pożądanego profilu uwalniania w procesie oczekiwanego trawienia enzymatycznego, z dominującym uwalnianiem w końcowym odcinku przewodu pokarmowego – w jelicie krętym i grubym (międzynarodowe zgłoszenie patentowe PCT/PL2024/050102).
Granulat wytwarzany jest przez otoczkowanie materiału zawierającego kwas masłowy (jony maślanowe) w podgrzanej homogennej mieszaninie mono- i diacylogliceroli, a następnie szybkie chłodzenie tej mieszaniny w komorze kondensacyjnej, co prowadzi do utworzenia jednorodnej matrycy lipidowej. Takie podejście pozwala uzyskać formę odporną na niskie pH żołądka, ale uwalniającą substancję czynną w odpowiedzi na enzymy obecne w dalszych odcinkach przewodu pokarmowego, zgodnie z fizjologicznymi warunkami trawienia.
Należy podkreślić, że proces uzyskiwania mikrogranulatu o oczekiwanym układzie przestrzennym, homogennym rozkładzie maślanu sodu w mikrogranulach i powtarzalnej wielkości mikrogranul jest niezwykle złożonym i wieloetapowym procesem, a tylko taki granulat gwarantuje oczekiwany profil uwalniania, z matrycą podatną na działanie enzymów trawiennych. Zatem zdecydowanie nie każdy mikrogranulat zapewnia optymalny profil uwalniania, co wykazano również w wynikach poniżej.
Większość mikrogranulatów ma przypadkowy układ nośnika i substancji aktywnych, co prowadzi do chaotycznego, przypadkowego i najczęściej bardzo szybkiego uwalniania maślanu.
Materiał i metody
W ocenie produktu, zastosowano dwie alternatywne metody imitujące warunki w przewodzie pokarmowym, które doprowadziły do zbliżonych wyników. Poniżej, opisano wyniki w zmodyfikowanym modelu Boisena, która jest bliższa autorowi tego opracowania. Natomiast przeprowadzono również symulację procesu trawienia in vitro w modelu INFOGEST z określeniem poziomu uwolnienia maślanu, gdzie skład mieszanin reakcyjnych imitujących warunki trawienia w żołądku i jelitach ustalono na podstawie literatury (Minekus et al. 2014).
Oceniano uwalnianie maślanu sodu z siedmiu preparatów, w tym Debutir Max, Maślan Sodu Forte (Health Labs), Butiner 500, Rebutestin Forte, Intesta Max, MultiLac IBS, Ibesan Maślan Forte. Użyto oznaczeń HPLC dla kolejnych odcinków przewodu pokarmowego: żołądek, dwunastnica, jelito czcze, kręte i grube. Obliczono efektywną dawkę jonu maślanowego (kwasu masłowego) w mg i szacowane stężenie w jelicie grubym.
W przeciwieństwie do klasycznych modeli farmakopealnych, które skupiają się wyłącznie na oporności formy leku wobec środowiska kwaśnego oraz zmianie pH, model zastosowany w niniejszej pracy uwzględnia fizjologicznie obecne enzymy (pepsyna, pankreatyna, celulaza, arabinaza, ksylanaza, pektynaza, ẞ-glukanaza), co pozwala na realne odwzorowanie warunków panujących w ludzkim przewodzie pokarmowym. Takie podejście umożliwia ocenę uwalniania nie tylko zależnego od pH, ale również od aktywności enzymatycznej, która jest kluczowa w ocenie biodostępności maślanu sodu (Boisen et al. 1997).
Krytyczna analiza uproszczonych modeli farmakopealnych, stosowanych w niektórych badaniach porównawczych, wskazuje na ich ograniczoną przydatność w ocenie profilowanego uwalniania. Modele te bazują na nierealistycznym założeniu stałego pH = 1 w żołądku, nie uwzględniając dynamicznych zmian środowiska trawiennego, jakie zachodzą w trakcie posiłku. Przykładowo, preparaty przyjmowane doustnie w warunkach fizjologicznych nie pozostają przez dwie godziny w warunkach silnie kwaśnych. PH treści żołądkowej po posiłku wzrasta do 5, a następnie obniża się do ok. 3, co zdecydowanie odmiennie wpływa na zachowanie formy preparatu wobec proponowanego farmakopealnie wspomnianego pH.
Opis metody
Badanie przeprowadzono na modelu sztucznego jelita (badanie trawienia in vitro, model enzymatyczny do zastawki krętniczo-kątniczej) dla siedmiu preparatów: Debutir Max (500 mg), Maślan Sodu Forte Health Labs, Butiner 500, Rebutestin, Forte, Intesta Max, MultiLac IBS, Ibesan Maślan Forte, według zmodyfikowanej metody Boisena[4].
Użyto oznaczeń HPLC dla kolejnych odcinków przewodu pokarmowe go: żołądek, dwunastnica, jelito czcze, kręte i grube. Obliczono efektywną dawkę jonu maślanowego w mg i szacowane stężenie w jelicie grubym.
Każdorazowo pomiar powtarzano dla 3 kapsułek/tabletek/saszetek danego preparatu – w dalszej części przedstawiono wynik uśredniony.
Badanie prowadzono zgodnie z poniższym schematem:
Etap I – mający na celu odzwierciedlenie warunków panujących w środowisku żołądka:
- do próbek preparatów dodano 10 ml 0,2 M HCl, a następnie wyrównano pH do 2;
- do powstałej mieszaniny dodano 1 ml świeżo przygotowanego roztworu zawierającego 25 mg pepsyny;
- tak przygotowane mieszaniny inkubowano w 38 st. C przez pół godziny;
- po godzinie inkubacji pobrano 1,5 ml roztworu z każdej z próbek w celu oznaczenia ilości uwolnionego kwasu masłowego.
Etap II – odzwierciedlenie warunków panujących w dwunastnicy i jelicie czczym:
- do mieszaniny powstałej w etapie I dodano 10 ml buforu fosforanowego (0,2 M pH 6,8) + 5 ml 0,6 M NaOH;
- pH wyrównano do 6,8 za pomocą 1 M HCl bądź 1 M NaOH;
- dodano 1 ml zawierający 100 mg pankreatyny oraz inkubowano ponownie w temperaturze 38 st. C przez 4 h; pankreatyna oddziałuje na matrycę triglicerydową próbek preparatu, gdyż wykazuje ona aktywność lipolityczną;
- po zakończeniu inkubacji pobrano 1,5 ml mieszaniny z każdej z prób oraz ewentualne pozostałe niestrawione mikrogranule.
Etap III – odzwierciedlenie warunków panujących w jelicie krętym:
Do mieszaniny powstałej w etapach I i II dodano 10 ml 0,2 M EDTA, pH 6,8.
- dodano 1 ml zawierający mieszaninę enzymatyczną celulazy, arabinazy, ksylanazy, pektynazy i ẞ-glukanazy; zestaw enzymatyczny wykazujący aktywność trawiącą wiązania glikozydowe;
- inkubowano ponownie w temperaturze 39 st. C przez 6 h;
- po zakończeniu inkubacji pobrano 1,5 ml mieszaniny z każdej z prób oraz ewentualne pozostałe niestrawione mikrogranule.
Oznaczanie stężenia wolnego maślanu wykonywano przy użyciu wysokosprawnej chromatografii cieczowej (HPLC, high-performance liquid chromatography) przy następujących parametrach: długość fali: 210 nm, przepływ fazy: izokratycznie 0,023 M H2SO4, nastrzyk: 5 μl, kolumna: Polypore H 10 μm 220 × 4,6 mm, 65 st. C, czas: 10 minut.
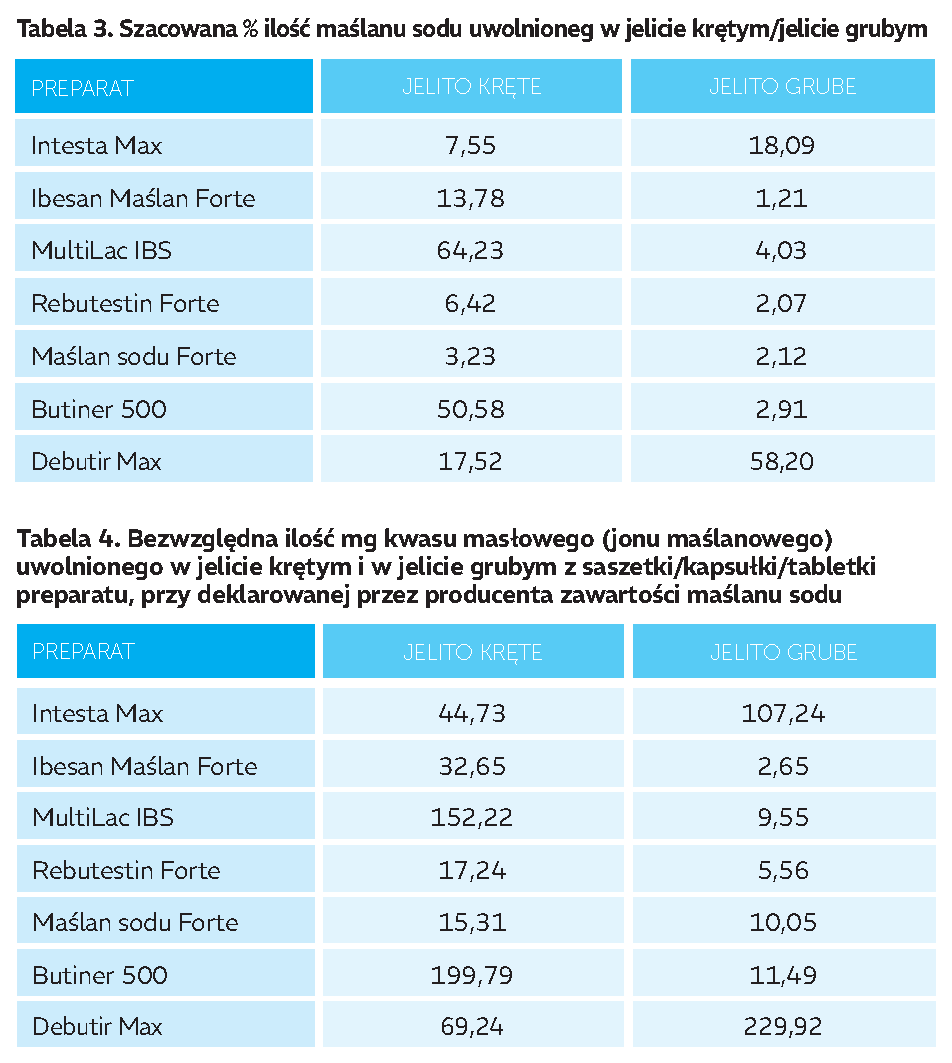
Wyniki
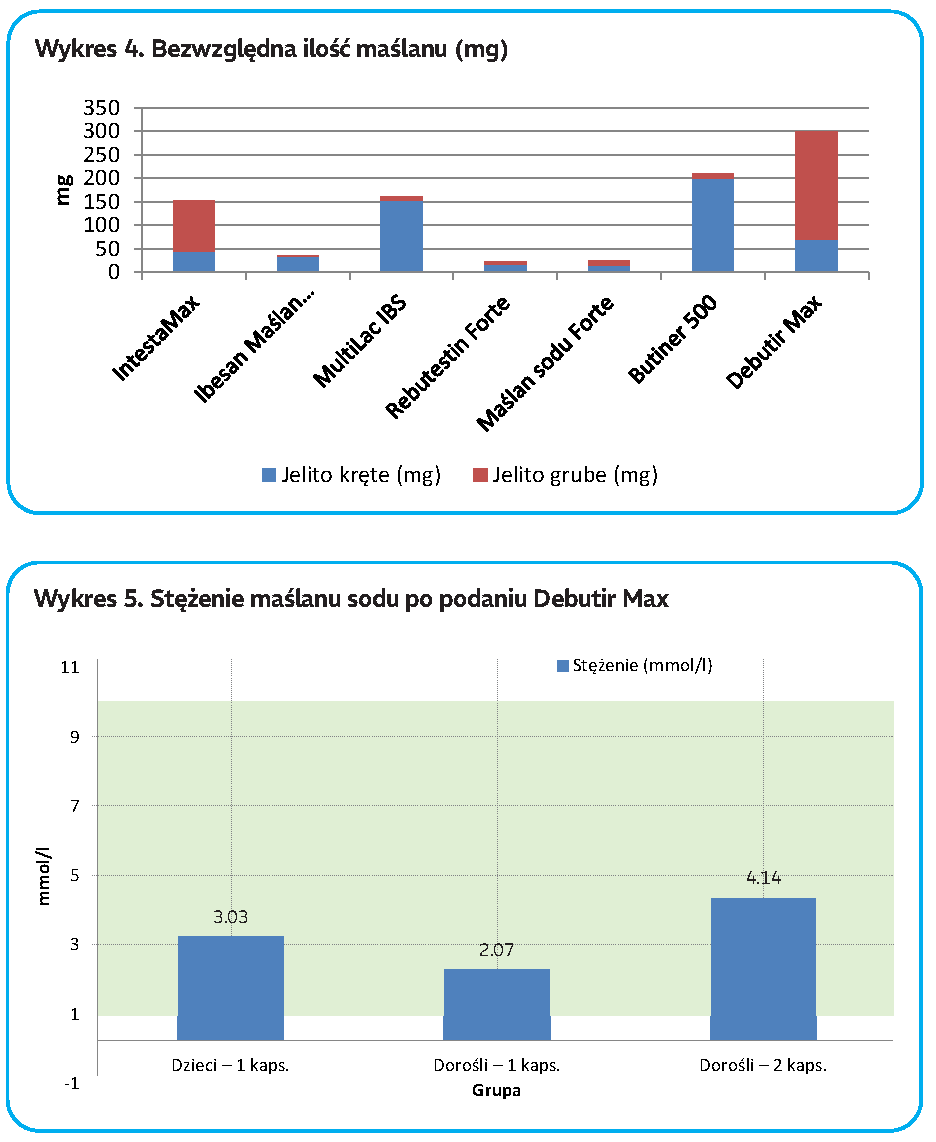
Debutir Max wykazał największy procent uwolnienia maślanu w jelicie grubym (58,2%) oraz istotne uwalnianie w jelicie krętym (17,5%).
Bezwzględna ilość kwasu masłowego (wartość oznaczona) docierającego do jelita grubego wyniosła 229,92 mg – najwyższy wynik spośród analizowanych preparatów.
Dla porównania:
- Intesta Max – 107,24 mg
- Butiner 500 – 11,49 mg
- Rebutestin Forte – 5,56 mg
- MultiLac IBS – 9,55 mg
- Ibesan Maślan Forte – 2,65 mg
- Maślan sodu Forte – 10,05 mg
Uzasadnienie dawki
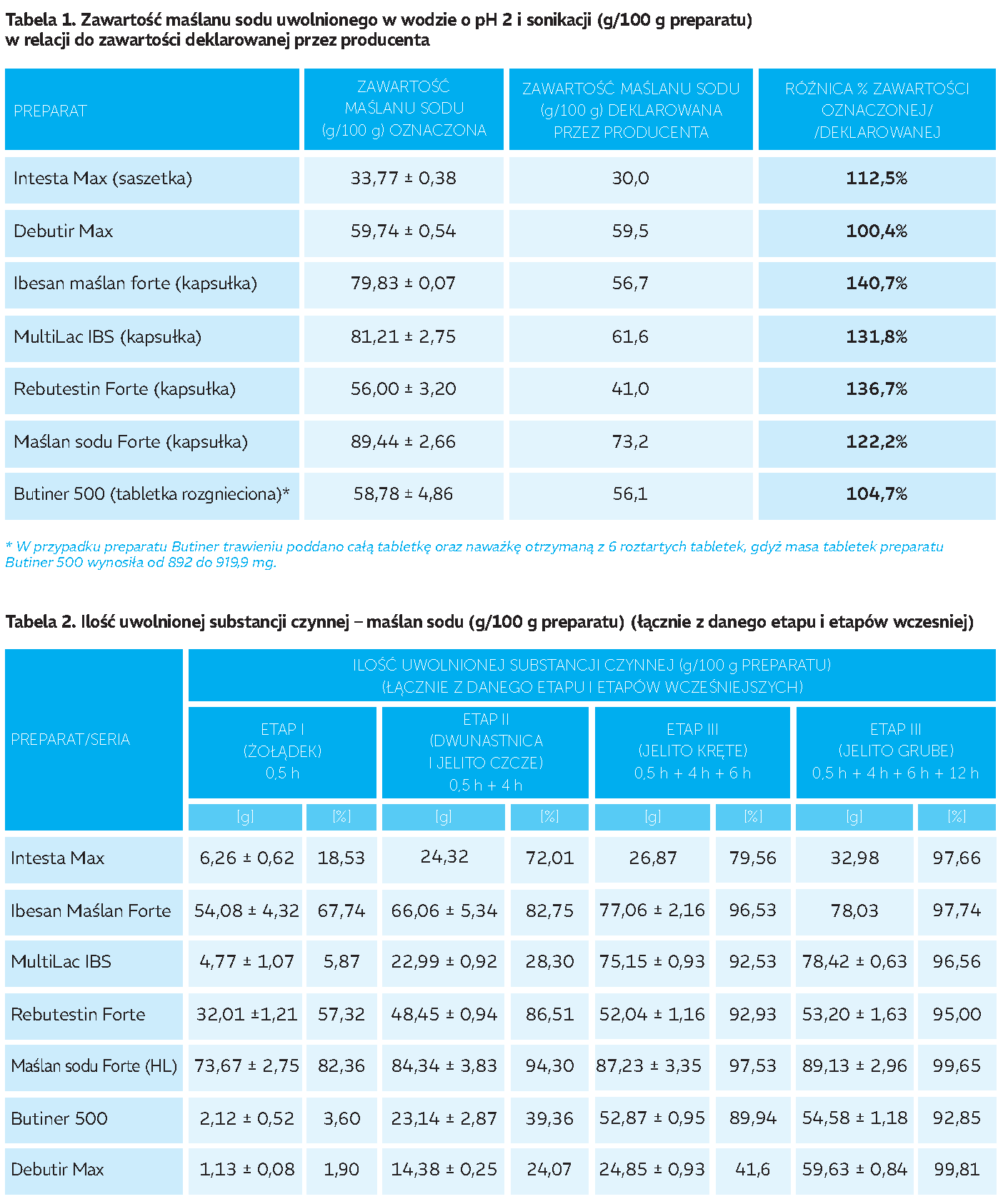
Opierając się na danych literaturowych, fizjologiczne stężenie endogennego kwasu masłowego w świetle jelita grubego zdrowego człowieka waha się w przedziale 1-10 mmol/l treści jelitowej.
Długość jelita grubego zwiększa się wraz z wiekiem od około 0,75 m u dzieci w wieku 4-6 lat do około 1,5 m u dorosłych. Fizjologiczna pojemność, czyli objętość jelita grubego wynosi:
- u dzieci w pierwszym roku życia około 500 ml;
- u dzieci starszych (powyżej 7. Roku życia) około 1 litr (2/3 osoby dorosłej);
- u dorosłych około 1,5 litra (Mirjalili et al. 2017).
1 mmol maślanu sodu = 110 mg maślanu sodu.
Z jednej kapsułki Debutir MAX (500 mg maślanu sodu) do jelita grubego dociera 229,92 mg kwasu masłowego (jonu maślanowego), czyli 2,1 mmol, co przekłada się na chwilowe potencjalne stężenie w świetle jelita grubego około 2 mmol/l; przy dwóch kapsułkach przyjętych jednocześnie około 4 mmol/l. W przypadku dzieci w wieku powyżej 7 lat, biorąc pod uwagę pojemność jelita grubego (2/3) i zbliżoną do osób dorosłych dynamikę pasażu przez cały przewód pokarmowy, chwilowe potencjalne stężenie w świetle zadanego jelita grubego wynosi około 3 mmol/l. Zaproponowane dawki maślanu mieszczą się zatem w granicach stężenia fizjologicznego u dzieci powyżej 7 lat i u dorosłych. Są bezpieczne i efektywne klinicznie. Warto zauważyć, że u dzieci młodszych chorobą objęte jest z reguły całe jelito grube, rzadko natomiast w przeciwieństwie do dorosłych zajęta bywa sama odbytnica, co wskazuje na nawet większe zapotrzebowanie żywieniowe na jony maślanowe u dzieci w przebiegu określonych chorób.
Podsumowanie
W świetle aktualnej wiedzy i danych literaturowych stosowanie wspomagające maślanu sodu w przebiegu zaburzeń czynnościowych i wielu chorób układu pokarmowego powinno opierać się na efektywnych dawkach maślanu sodu. Według polskich ekspertów za skuteczną profilaktyczną dawkę maślanu sodu można uznać 300-600 mg na dobę, natomiast skuteczne dawki terapeutyczne zależnie od nasilenia objawów chorobowych powinny być odpowiednio większe od minimum 600 mg do nawet do 1000-1500 mg maślanu sodu na dobę[17].
Poza odpowiednio wysoką dawką równie istotny jest profil uwalniania maślanu sodu z preparatu, czyli dynamika rozpadu nośnika w warunkach fizjologicznych przewodu pokarmowego na poszczególnych odcinkach jelita. W kontekście powyższego tylko preparaty wykazujące reaktywność na obecność enzymów i zmienność środowiska jelitowego mogą dostarczać maślan sodu do miejsca docelowego – jelita grubego. Takie właściwości posiada technologia nośnika zastosowanego w Debutir Max, o zrównoważonym i powtarzalnym składzie i układzie przestrzennym. Umożliwia to efektywne wspomaganie leczenia schorzeń takich jak IBD, IBS, choroba uchyłkowa. Rozwiązanie to otwiera również nowe możliwości terapeutyczne, zwłaszcza w leczeniu schorzeń takich jak SIBO, po uwzględnieniu biodostępności w jelicie krętym na poziomie prawie 70 mg z jednej kapsułki.
Odpowiednie nawodnienie organizmu w upalne dni
Dieta niskofosforanowa w niewydolności nerek